أنطونيو ريغالادو
سلَّط أنطونيو ريغالادو، الضوءَ في هذا المقال على الجهود العلمية المبذولة لتعديل الجينات البشرية؛ حيث شهدت مدينة لندن، في مطلع مارس الماضي، اجتماع القمة الدولية الثالثة حول تعديل الجينوم البشري، وهي الحدث الدولي الأكبر في هذا الشأن؛ إذ يستعرض الباحثون قدراتهم الجديدة على تعديل الحمض النووي البشري، الأمر الذي يثير قلقاً كبيراً عند علماء الأخلاقيات.
بدأ الحدث بإلقاء نظرة على ما سمَّاه المنظمون “إساءة استخدام” التكنولوجيا في الصين للحصول على أطفال مصممين حسب الرغبة في الصين عام 2018؛ الأمر الذي أثار عاصفة أخلاقية وأسئلة عميقة حول ما إذا كان ينبغي لنا التدخل في عملية التطور. ولكن الجدل حول الطفل المصمم حسب الطلب، هو إلهاءٌ عن القصة الحقيقية حول الطريقة التي يغير بها تعديل الجينات حياة الناس من خلال علاج أشخاص بالغين مصابين بأمراض خطيرة.
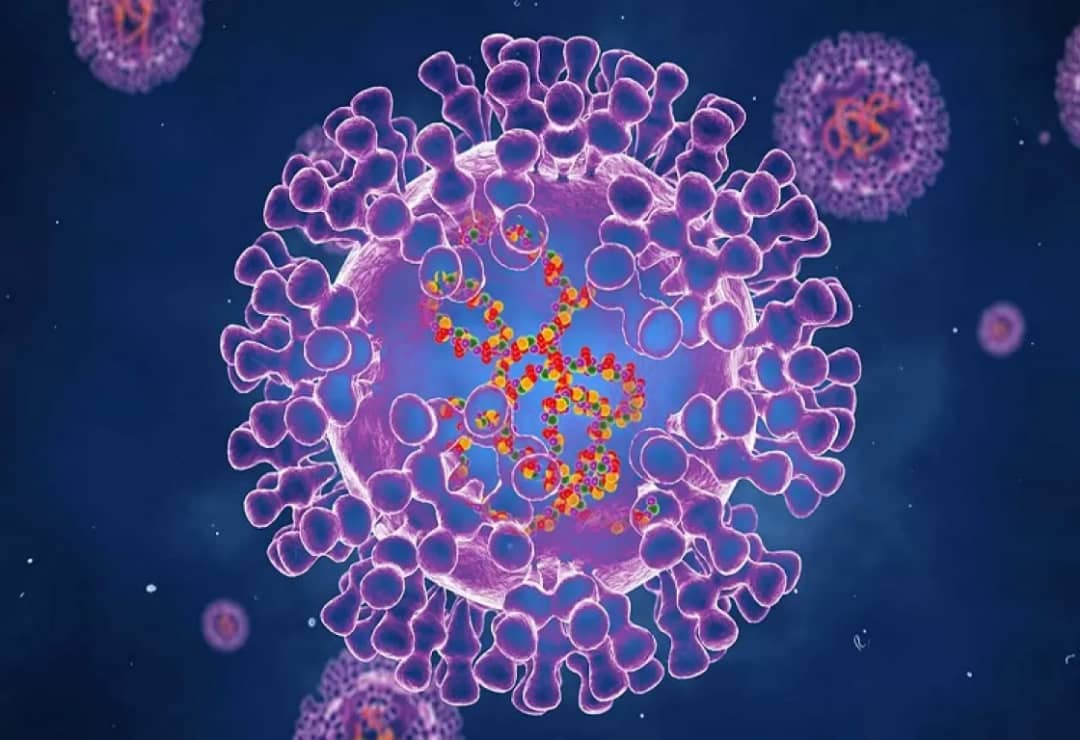
في الواقع؛ تُجرى الآن أكثر من 50 دراسة تجريبية حول كيفية تعديل جينات أشخاص متطوعين، من أجل علاج كل شيء؛ من السرطان إلى فيروس نقص المناعة وأمراض الدم. ويعتمد نحو 40 من هذه الدراسات على تقنية كريسبر (CRISPR)؛ وهي أكثر طرق تعديل الجينات تنوعاً، وتم تطويرها قبل عشر سنوات فقط.
فيكتوريا غراي كانت واحدة من أوائل المرضى المتطوعين الذين عولجوا باستخدام تقنية كريسبر عام 2019؛ ألقت كلمةً في اجتماع القمة أبكت كل الحاضرين. قالت غراي عن معركتها مع المرض “أقف اليوم هنا أمامكم لأن المعجزات لا تزال تحدث”؛ لكن حالة غراي تظهر أيضاً الجوانب السلبية للتقنية والعقبات التي تواجه الجيل الأول من علاجات “كريسبر”.
تقول شركة “فيرتيكس للصناعات الدوائية” التي طورت علاج غراي، إنها عالجت أكثر من 75 شخصاً في دراستها حول الخلايا المنجلية ومرض الثلاسيميا المرتبط بها، وإنه من الممكن الموافقة على طرح العلاج للبيع في الولايات المتحدة في غضون عام واحد. ولم تذكر الشركة كم ستبلغ تكلفة العلاج؛ ولكن من المتوقع أن تصل تكلفته إلى عدة ملايين من الدولارات.
كان تطور هذه التقنية لاستخدامها في العلاج سريعاً للغاية. يقول الباحث في جامعة كاليفورنيا، فيودور أورنوف: “أعتقد أن تقنية كريسبر قد تفوقت على كل تقنيات العلاج الجينومي السابقة”. ويعتبر العلماء هذه التقنية اكتشافاً مهماً؛ لأنها تستطيع قطع جينوم في أماكن محددة وتعتمد على قطعة من البروتين مقترنة بتسلسل جيني قصير؛ تعمل مثل نظام تحديد المواقع العالمي (GPS)، وتنتقل إلى مكان محدد مسبقاً في كروموسومات المريض. وهي تقنية تتيح إجراء تغييرات مبرمجة على الحمض النووي.
بالإضافة إلى “فيرتيكس”؛ هنالك عدد من شركات التكنولوجيا الحيوية تأمل في أن تتمكن من استخدام هذه التكنولوجيا لتطوير علاجات ناجعة، وبدأت العديد من هذه الشركات بإجراء تجاربها السريرية؛ ولكن النجاح لن يكون حليف كل هذه التجارب. فعلى سبيل المثال، في يناير الماضي، اضطرت شركة “غرافايت بايو” للتكنولوجيا الحيوية، في سان فرانسيسكو، إلى إيقاف اختباراتها القائمة على تعديل الجينات للخلايا المنجلية بعد أن انخفض عدد خلايا الدم عند مريضها الأول بشكل خطير بسبب العلاج. وأدى هذا الفشل إلى انخفاض سعر سهم الشركة بأكثر من 90% وتهديد مستقبلها بأكمله.
لا تزال المعضلة التي تواجه كل هذه الجهود تتمثل في إيصال “كريسبر” إلى المكان المطلوب في الجسم. وهذا أمرٌ في غاية الصعوبة. ففي حالة غراي، أزال الأطباء خلايا نخاع العظم وعدلوها في المختبر؛ ولكن قبل إعادتها إلى جسدها خضعت غراي إلى علاج كيميائي لقتل ما تبقى من خلايا نخاع العظم، من أجل إفساح المجال أمام الخلايا الجديدة.
في الأساس، يتطلب علاج شركة “فيرتيكس” زرع خلايا نخاع العظم، وهذه محنة في حد ذاتها لا يستطيع تحملها كل المرضى، وتعتقد الشركة أن العلاج سيكون مناسباً للحالات الشديدة التي يقدر عددها بـ32,000 شخص في الولايات المتحدة وأوروبا. ومع ذلك لن يحصل المرضى على العلاج إذا امتنعت شركات التأمين والحكومات عن دفع ثمنه، وفي ذلك مخاطرة حقيقية بالنسبة إلى الشركات الصانعة. فعلى سبيل المثال، تم سحب علاج جيني آخر للثلاسيميا طورته شركة “بلوبيرد بايو” من السوق الأوروبية، بعد أن رفضت الحكومات هناك دفع سعره البالغ 1.8 مليون دولار.
ومن عيوب الجيل الأول من علاج “كريسبر”، أنه يعمل بشكل أساسي على إتلاف الحمض النووي وإغلاق الجينات؛ وهي عملية وصفها عالم الأحياء جورج تشيرش، بأنها “تخريب الجينوم”. من خلال كسر جزء محدد من الحمض النووي، يطلق علاج غراي نسخة ثانية من جين الهيموجلوبين الذي يستخدمه الناس في طفولتهم. ونظراً لأن الهيموجلوبين هو البروتين الشاذ في الخلية المنجلية؛ فإن وجود نسخة أخرى منه يحل المشكلة. ويعمل عالِم التعديل الجيني، ديفيد ليو، الآن، على الجيل الثاني من بروتين كريسبر المصمم؛ ليس لقطع الحمض النووي، بل لاستبدال الحروف الجينية الفردية أو إجراء تعديلات أكبر تُعرف باسم “التعديلات الأساسية”. ويتوقع العلماء أن الجيل الثاني سيكون أفضل أداء وأقل مخاطر؛ لكن إيصاله إلى الخلايا المستهدفة لا يزال صعباً.
تهدف جميع تجارب كريسبر الجارية الآن إلى معالجة إما السرطان وإما الخلايا المنجلية. ووفقاً لأرونوف فإن هذا يعني أنه يتم تجاهل الآلاف من الأمراض الوراثية الأخرى التي يمكن علاجها باستخدام تقنية كريسبر. ويقول: “هذا يرجع إلى حقيقة أن معظم هذه الأمراض نادرة جداً؛ بحيث لا تشكل فرصة تجارية مجدية”.
ومع ذلك، فقد قدم أورنوف أفكاره في اجتماع لندن حول كيفية اختبار العلاجات حتى للأمراض النادرة جداً؛ بما في ذلك بعض الحالات الوراثية غير العادية، إلى درجة أنها تصيب شخصاً واحداً فقط. وقال أورنوف: “هذه ليست فرصة تجارية؛ ولكن بفضل إمكانية برمجة كريسبر للذهاب إلى أي مكان في الجينوم، فهذا الأمر ممكن علمياً”. وأضاف: “الآن، وبعد أن حقق تعديل الجينات نجاحاته الأولى، أصبحت الحاجة ملحة لفتح طريق العلاج أمام الجميع”.
نقلاً عن “كيوبوست”